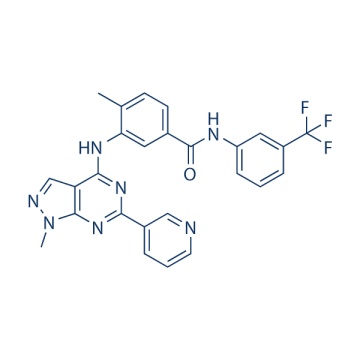
NVP-BHG712 940310-85-0
Descripción del producto
.cp_wz tabla {borde superior: 1px sólido #ccc; borde izquierdo: 1px sólido #ccc; } .cp_wz table td {borde derecho: 1px sólido #ccc; borde inferior: 1px sólido #ccc; padding: 5px 0px 0px 5px;} .cp_wz table th {border-right: 1px solid #ccc; border-bottom: 1px solid #ccc; relleno: 5px 0px 0px 5px;} \ n Peso molecular: \ n 503.48 NVP-BHG712 es un inhibidor específico de EphB4 con ED50 de 25 nM que discrimina entre la inhibición de VEGFR y EphB4; también muestra actividad contra c-Raf, c-Src y c-Abl con IC50 de 0.395 μM, 1.266 μM y 1.667 μM, respectivamente. \ n Actividad biológica El tratamiento con NVP-BHG712 también conduce de manera dependiente de la dosis a la inhibición de la autofosforilación de RTK en transfectados estables Células de melanoma A375 con EC50 de 25 nM y 4,2 μM para EphB4 y VEGFR2, respectivamente. En un modelo de angiogénesis inducida por factor de crecimiento, NVP-BHG712 (3 mg / kg, po) suprime significativamente la formación de tejido estimulada por VEGF y la vascularización al inhibir la señalización directa de EphB4. Además, NVP-BHG712 (10 mg / kg / kg, po) revierte potencialmente la formación de tejido y el crecimiento de vasos potenciados por VEGF. NVP-BHG712 (3 mg / kg, po) muestra una exposición duradera con concentraciones de alrededor de 10 μM en plasma, así como en tejido pulmonar e hepático durante hasta 8 horas, y por lo tanto da como resultado una inhibición duradera de la actividad de la quinasa EphB4 en ratones. \ n Ensayos de quinasas in vitro Todos los ensayos de quinasas in vitro se realizan con quinasas purificadas recombinantes adquiridas de proveedores externos o producidas internamente. Para estimar la actividad de la quinasa, se utilizan tanto LanthaScreenTM basado en TR-FRET como el cambio de movilidad Caliper. En resumen, la tecnología del ensayo LanthaScreenTM se basa en la discriminación entre el sustrato no fosforilado y el producto fosforilado por un anticuerpo fosfoespecífico, que se une solo a la versión fosforilada del sustrato. Tanto el anticuerpo como el sustrato portan etiquetas fluorescentes y la proximidad de las etiquetas en el complejo formado permite la medición de una señal de transferencia de energía por resonancia de fluorescencia (FRET). La lectura de la señal FRET de una manera dependiente del tiempo / controlada por el tiempo mejora aún más el rendimiento del ensayo al reducir la fluorescencia de fondo. Para las mediciones de respuesta a la dosis, NVP-BHG712 se prediluye en DMSO al 90% y se dispensan 50 nL de soluciones compuestas directamente en la placa de ensayo vacía utilizando un nanodispensador HummingBird. Las reacciones de quinasa se inician mediante la adición de 4,5 μL de solución de ATP (4 μM de ATP, 20 mM Tris / HCL, 1 mM DTT, 0,03% de Tween20, 0,01 mM Na3VO4) y 4,5 μL de mezcla de enzima / sustrato (100 nM de fluoresceína poli-GAT). , Albúmina de suero bovino al 0,5%, Tris / HCL 20 mM, DTT 1 mM, Tween20 al 0,03%, Na3VO4 0,01 mM). Otros componentes de la mezcla de enzima / sustrato son las enzimas, así como MgCl2 / MnCl2, que se ajustan específicamente a los requisitos de la enzima individual. Después de la incubación durante 60 minutos a ta, las reacciones de la quinasa se detienen mediante la adición de 4,5 μL de solución de parada (EDTA 50 mM pH 8,0, NP-40 al 0,04%, Tris / HCl 20 mM pH 7,4) seguido de 4,5 μL de mezcla de detección (1,72 μg / ml de anticuerpo Tb-PY20), albúmina de suero bovino al 1%, Tris / HCl 20 mM, DTT 1 mM, Tween20 al 0,03%, Na3VO4 0,01 mM). Después de la incubación durante 45 minutos a temperatura ambiente, las placas se analizan en un lector de placas BMG PHERAstar. En los ensayos de cambio de movilidad de Caliper, las reacciones de quinasa se analizan mediante electroforesis capilar de microfluidos. La transferencia de fosfato del ATP a un péptido corto por una quinasa provoca un cambio en la carga neta del péptido en -2. La diferencia de carga entre las entidades fosforiladas y no fosforiladas del péptido se puede separar en un campo eléctrico. El uso de péptidos unidos con una etiqueta fluorescente permite la detección y cuantificación de ambas formas y, por lo tanto, el cálculo de la rotación de la reacción. Para las mediciones de respuesta a la dosis, NVP-BHG712 se prediluye en DMSO al 90% y se dispensan alícuotas de 50 nL de solución directamente en la placa de ensayo vacía utilizando un nanodispensador HummingBird. Las reacciones de quinasa se inician mediante la adición de 4,5 μL de mezcla de sustrato que consta de ATP y sustrato peptídico en tampón de ensayo (HEPES 50 mM pH 7,5, albúmina de suero bovino al 0,02%, DTT 1 mM, Tween20 al 0,02%, Na34 0,01 mM, beta 10 mM glicerofosfato) y 4,5 μL de solución enzimática en tampón de ensayo. La concentración de péptido es 2 µM en los ensayos. Las concentraciones de la enzima, así como de MgCl2 y MnCl2, se ajustan específicamente a los requisitos de la enzima individual. Las concentraciones de ATP se ajustan a los valores de Km de la enzima específica. Después de la incubación durante 60 minutos a 30 ° C, las reacciones de la quinasa se detienen mediante la adición de 16 μL de solución de parada (HEPES 100 mM pH 7,5, DMSO al 5%, reactivo de revestimiento al 0,1% EDTA 10 mM pH 8,0, BRIJ35 al 0,015%). Las reacciones de quinasa detenidas se analizan en un lector LC3000.
Grupos de Producto : Proteína tirosina quinasa > Inhibidor del receptor de efrina
Otros productos
Productos hot
Astragalósido AClortetraciclina HCl 64-72-2Paclitaxel 33069-62-4Acetato de dexametasona 1177-87-3Dinaciclib (SCH727965) 779353-01-4CHIR-124 405168-58-3Ro3280 1062243-51-9TAME 901-47-3CCG-1423 285986-88-110058-F4 403811-55-2Dabigatrán (BIBR 953) 211914-51-1H 89 2HCl 130964-39-5T0901317 293754-55-9Aprepitant 170729-80-3Turofexorate Isopropil (XL335) 629664-81-9BMS-378806 357263-13-9